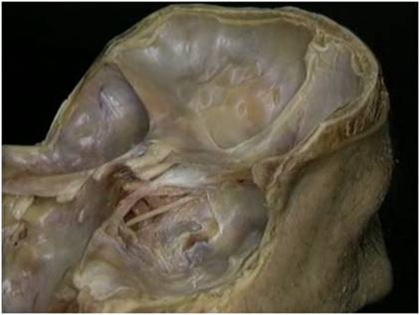
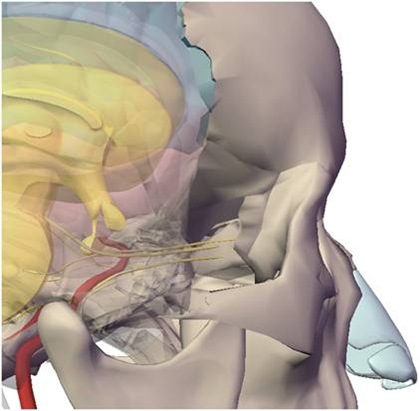
JOÃO LOPES TOLEDO-FILHO **
CLÓVIS MARZOLA ***
IVÁN LEONARDO SÁNCHEZ-TORO ****
JOÃO LOPES TOLEDO-NETO *****
_________________________________________________________________________________________
* Monografia apresentada como parte dos requisitos para a conclusão do Curso de Residência em Cirurgia e Traumatologia Buco Maxilo Facial, promovido pelo Colégio Brasileiro de Cirurgia e Traumatologia Buco Maxilo Facial e Hospital de Base da Associação Hospitalar de Bauru.
** Professor Titular de Anatomia da Faculdade de Odontologia de Bauru. Professor do Curso de Residência e Orientador do trabalho.
*** Professor Titular de Cirurgia da Faculdade de Odontologia de Bauru Aposentado. Professor do Curso de Residência e Orientador Adjunto do trabalho. Professor de Cirurgia da UNIP de Bauru.
**** Autor da Monografia, concluente do Curso e aspirante ao título de Especialista pelo Colégio Brasileiro de Cirurgia e Traumatologia Buco Maxilo Facial.
***** Professor de Cirurgia da UNIP de Bauru.
RESUMO
A transposição no nervo alveolar inferior (NAI) é uma técnica cirúrgica praticada há várias décadas com diversas finalidades, antes de ser introduzida para colocação de implantes. Também, já havia preocupação com as eventuais alterações neurosensoriais provocadas por esses procedimentos, decorrentes da manipulação de feixes nervosos e, foram assim estabelecidos vários métodos para serem avaliadas essas alterações. A transposição do NAI é uma das opções para a reabilitação protética de pacientes com defeitos ósseos ou reabsorção alveolar moderada ou mesmo severa, posterior ao forame mentoniano e, que têm intolerabilidade às próteses removíveis. Outras possibilidades são as enxertias ósseas, os implantes curtos, a colocação do implante vestibular ao canal alveolar, o uso de implantes mais enxertos de material implantar sobre o rebordo e, mais recentemente a osteogênese por distração. São contra-indicadas, essas manobras, em pacientes com alterações sistêmicas que possam comprometer sua integridade e os resultados dessa cirurgia, tais como, discrasias sangüíneas, osteoporose, diabetes não controlado, sendo também relevantes às alterações de comportamento. Este trabalho procura mostrar através da técnica cirúrgica que todo cirurgião especialista tem amplas condições de realizar esse procedimento com inteiro sucesso.
INTRODUÇÃO
A transposição no nervo alveolar inferior (NAI) é uma técnica cirúrgica praticada há várias décadas com diversas finalidades, antes de ser introduzida para colocação de implantes. Já se realizava essa cirurgia para aumento e plastias de rebordo alveolar (01, 17) e, correções de más oclusões (14, 19, 23), sendo indicada ainda para preservação e reparação do nervo em ressecções mandibulares.
Também, já havia preocupação com as eventuais alterações neurosensoriais provocadas por esses procedimentos, decorrentes da manipulação de feixes nervosos e, foram assim estabelecidos vários métodos para serem avaliadas essas alterações (05, 20, 33). Diversos autores já destacavam que além da cirurgia ser criteriosamente indicada deveria haver pleno esclarecimento e concordância do paciente, com relação ao tipo de procedimento com suas possíveis e quase inevitáveis seqüelas (01, 14, 17, 19, 23).
O primeiro relato de transposição de nervo alveolar para colocação de implantes pertence à JENSEN; NOCK, 1987 (13), que já ilustravam as duas principais variações da técnica, envolvendo o forame mentoniano ou não. As primeiras casuísticas relatadas na literatura (25), propondo a técnica de transposição do NAI (com envolvimento do forame mentoniano), além do relato de casos apenas com a transposição parcial (lateralização) do feixe neurovascular (30).
A transposição do NAI é uma das opções para a reabilitação protética de pacientes com defeitos ósseos ou reabsorção alveolar moderada ou mesmo severa, posterior ao forame mentoniano e, que têm intolerabilidade às próteses removíveis (25, 26, 27). Outras possibilidades são as enxertias ósseas, os implantes curtos, a colocação do implante vestibular ao canal alveolar, o uso de implantes mais enxertos de material implantar sobre o rebordo (09) e, mais recentemente a osteogênese por distração (32). São contra-indicadas, essas manobras, em pacientes com alterações sistêmicas que possam comprometer sua integridade e os resultados dessa cirurgia, tais como, discrasias sangüíneas, osteoporose, diabetes não controlado, sendo também relevantes às alterações de comportamento.
As principais vantagens da transposição do NAI em relação à colocação de implantes sobre ou ao lado do canal alveolar são de menor necessidade de mensurações exatas, baixo risco de lesão durante a perfuração ou por compressão, possibilidade de fixar implante mais longos e, com melhor estabilidade inicial. Possibilita assim, melhor organização das linhas de tensão, pela fixação na cortical basal (12, 25, 30), levando a um aumento da resistência às forças oclusais e, uma boa proporção entre o implante e a prótese (28).
Permite além do mais uma orientação correta dos implantes pela possibilidade de visão direta (28) e, utilizando-se das corticais o implante fica rodeado de osso de melhor qualidade, ao contrário dos implantes colocados com material implantar sobre o rebordo (09). Quanto aos métodos de reconstrução com enxertos, a transposição é um procedimento relativamente simples, sem necessidade de áreas doadoras, anestesia geral, baixa morbidade, resultados estáveis (06, 13, 25), além de apresentar um custo menor.
Como desvantagens à transposição do NAI, não recupera a anatomia do rebordo alveolar, fragiliza temporariamente a mandíbula (15) e, principalmente envolve o risco de que as eventuais alterações sensoriais (hipoestesia e parestesia) sejam permanentes (02, 34).
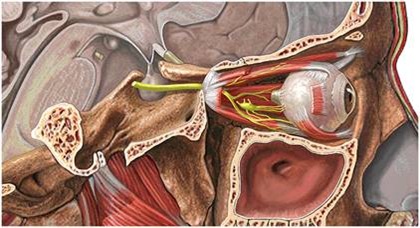
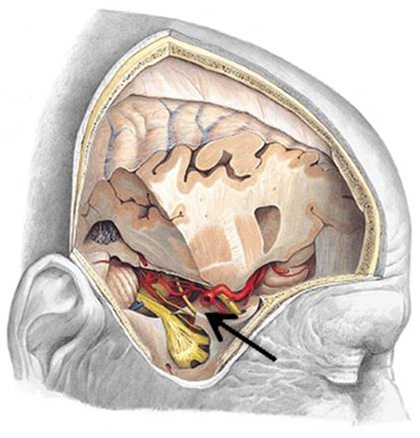
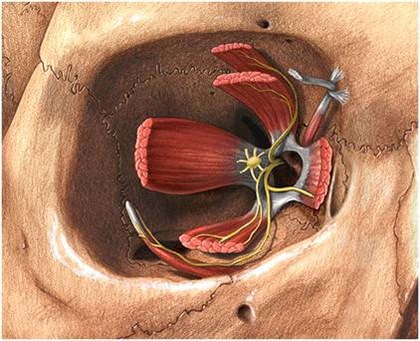
No planejamento, além de envolver os procedimentos de rotina para a colocação de implantes, na avaliação do paciente deve-se ter especial atenção para as características anatômicas do canal mandibular e do forame mentoniano.
As principais relações do canal mandibular são:
1. O canal mandibular tem trajeto oblíquo, estando na região de molar próximo à cortical lingual e na região de pré-molares aproxima-se da tábua vestibular. As medidas médias do canal à cortical vestibular externa são de 6 mm na região de molares, diminuindo para 2,5mm na região de pré-molares.
2. No sentido vertical a distância do canal ao rebordo basal esterno inicia-se no forame mentoniano com uma média de 17 mm e diminui progressivamente até na região de molares com valores médios de 7,3 mm, voltando a aumentar na região mais posterior do corpo mandibular.
3. O canal possui diâmetro médio de 3,7mm e à medida que se aproxima do forame mentoniano diminui para 2,9mm (31). No trajeto final do canal mandibular ocorre uma divisão em canal incisivo e, a saída do nervo mentoniano, que poder variar formando uma curva (03).
Radiograficamente, além do planejamento para os implantes, são avaliados todo o trajeto do nervo alveolar e a posição do forame mentoniano, utilizando-se da ortopantomografia, ou ainda de tomografia computadorizada (16).
Pode-se com isso fazer um traçado predicativo do local das osteotomias e, na tomografia, avaliar densidade do osso medular, a espessura das corticais e, as medidas precisas da posição do canal mandibular em todo seu trajeto
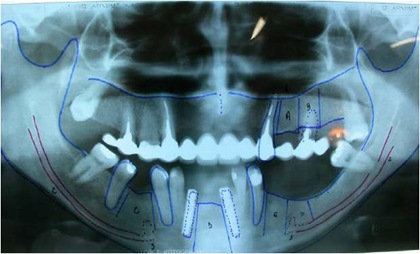
Fig. 1 - Radiografia ortopantomográfica mostrando o traçado do canal do nervo alveolar inferior.
Um fator fundamental na indicação dessa técnica cirúrgica é o pleno esclarecimento do paciente de outras possibilidades de reabilitação protética, tais como próteses removíveis, extração dos dentes remanescentes e fixação de implantes na região anterior da mandíbula (07, 08), enxertos e, das possíveis seqüelas decorrentes da manipulação do NAI, além do consentimento escrito (01, 02, 06, 09, 13, 18, 25, 28, 30).
TÉCNICA CIRÚRGICA
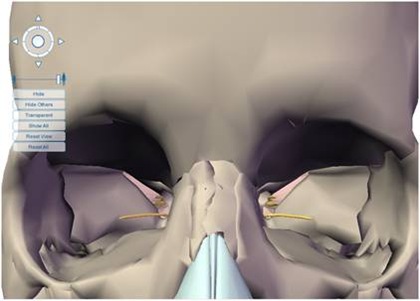
Estudo radiográfico perfeito para a concretização da manobra cirúrgica, levando-se em consideração todos os detalhes da localização do plexo alveolar inferior e suas relações anatômicas (Figs. 2 e 3).
Este procedimento pode ser realizado sob anestesia local, podendo ser associado à prescrição de ansiolíticos ou à sedação. Recomenda-se o uso de anestésicos locais potentes, como a bupivacaine, tendo em vista que é um procedimento que em mãos experientes demora em média duas a três vezes o tempo necessário para a fixação dos implantes (24).
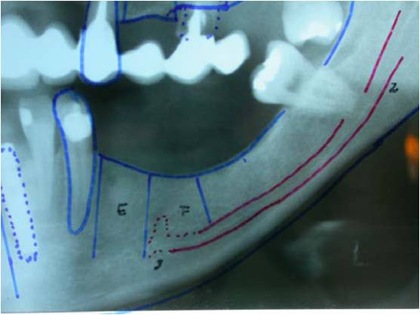
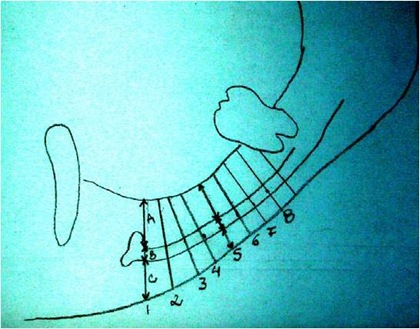
Figs. 2 e 3 – Aspecto radiográfico mostrando a perfeita localização do plexo alveolar inferior com as medidas corretas para a manobra cirúrgica com a localização do implante.
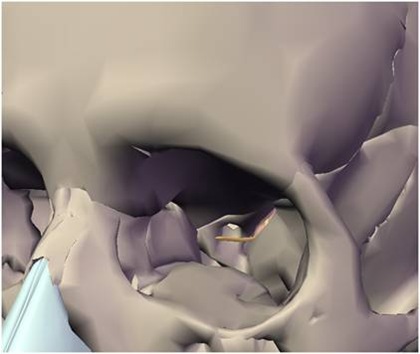
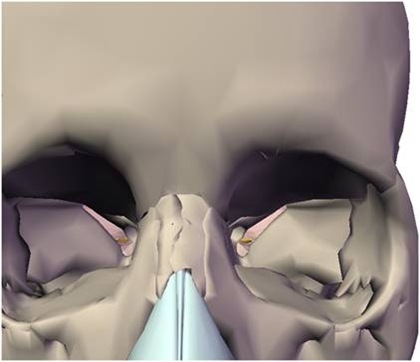
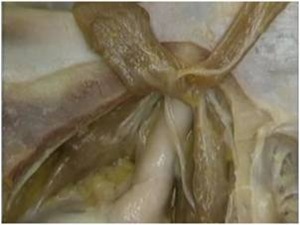
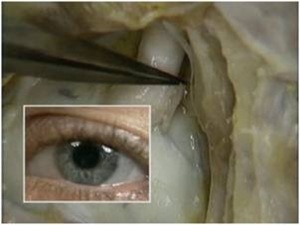
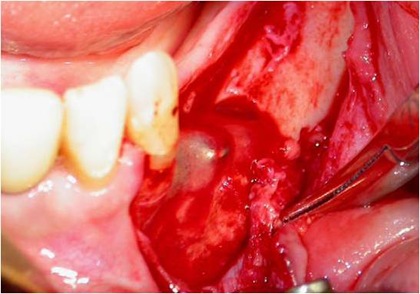
A incisão deve ser linear sobre a crista alveolar, iniciada no trígono retromolar e, com pequeno desvio para lingual, segue em direção à região do canino, sendo acompanhada de uma extensão no rebordo alveolar vestibular anterior ao canino, como forma de garantir um retalho que irá cobrir todo o defeito ósseo, protegendo-o de fenestrações ou de infecções. Uma vez descolado o retalho localiza-se o forame mentoniano e libera-se com extremo cuidado o periósteo do feixe no nervo mentoniano (Fig. 4).
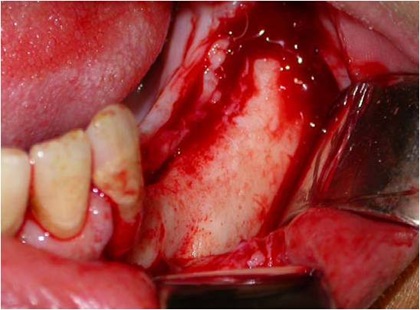
Fig. 4 - Após a incisão o retalho totalmente afastado, mostrando o forame mentoniano já perfeitamente liberado do periósteo.
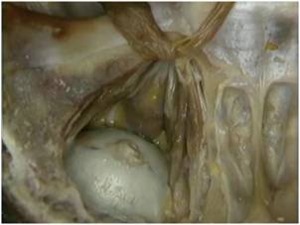
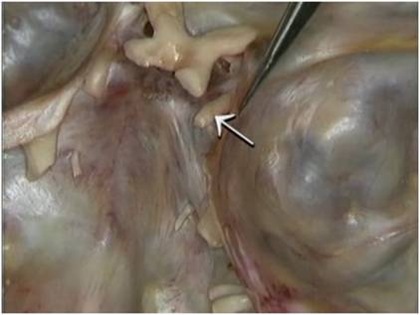
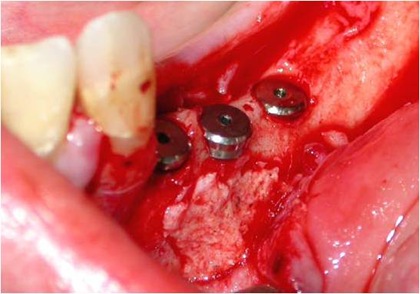
As osteotomias são demarcadas com brocas esféricas pequenas e a seguir, completadas com brocas fenestradas ou serras reciprocantes e oscilantes, descolando-se a cortical vestibular com cinzéis delicados. A remoção do osso medular e da parede do canal mandibular realiza-se com curetas delicadas. A manipulação do NAI exige o uso de instrumentos de contorno suaves e tiras de látex (35) (Figs. 5, 6 e 7).
O tamanho e a localização das osteotomias irá depender da técnica adotada. A transposição do NAI consiste numa osteotomia ao redor do forame mentoniano, removendo-o e, a seguir, a confecção de uma janela óssea posterior seguindo o trajeto do canal mandibular (25).
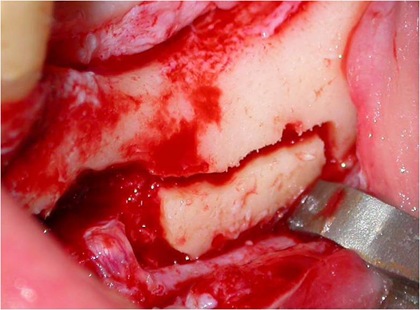
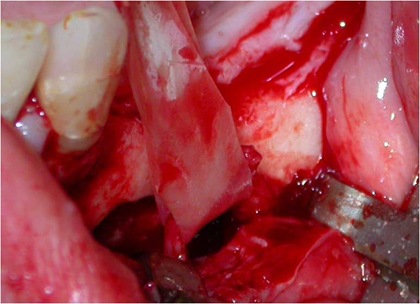
Figs. 5, 6 e 7 - A osteotomia completa com a remoção da medular. Essa remoção do osso medular e da parede do canal mandibular realiza-se com curetas delicadas. A manipulação do NAI exige o uso de instrumentos de contorno suaves e tiras de látex, com sua transposição.
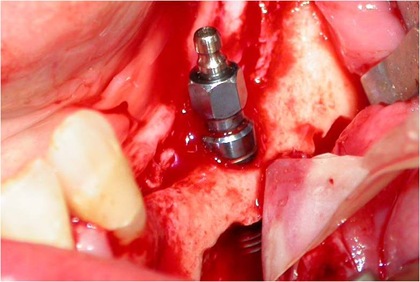
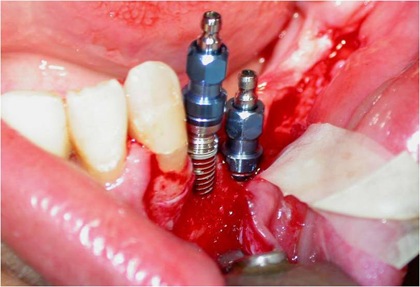
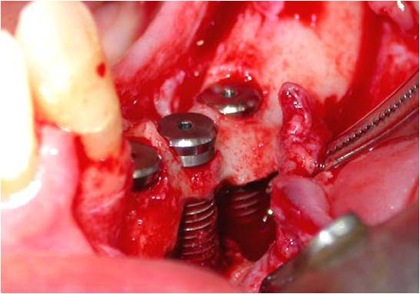
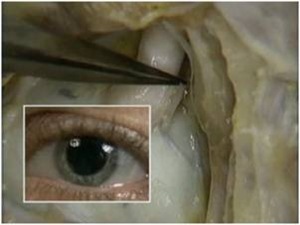
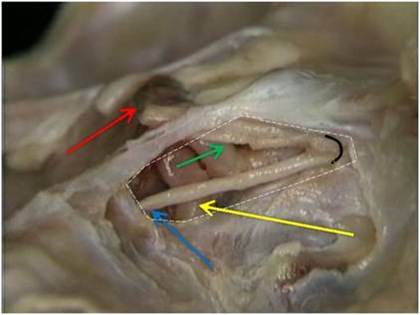
Figs. 8, 9 e 10 - Os implantes já perfeitamente fixados, com a suave deposição do plexo alveolar inferior na sua loja cirúrgica.
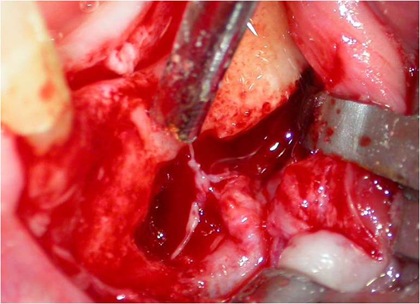
Uma vez localizado o canal mandibular sua parede é cuidadosamente retirada, liberando-se progressivamente o feixe neurovascular. Eventualmente, por uma outra técnica há necessidade de se realizar a transposição do nervo incisivo para se obter um afastamento satisfatório do NAI. Após o afastamento do feixe, realiza-se a fixação dos implantes, seguindo o protocolo correspondente, utilizando-se da cortical basal ou não, para obter uma melhor estabilidade inicial (24, 30) (Figs. 8, 9 e 10). Na seqüência o NAI é acomodado passivamente na loja óssea quando apenas lateralizado (12, 29).
Existem ressalvas quanto à colocação de materiais implantares pela possibilidade de infecções e, uma vez que o defeito ósseo é coberto completamente pelo periósteo haverá reparação dessa área (09). Alguns autores indicam a colocação de membranas para dar maior sustentação do retalho sobre a janela formada (30). O preenchimento da cavidade com osso particulado assim como o recobrimento do local com uma barreira biológica é um procedimento que traz bons resultados (Figs. 11 e 12).
Figs. 11 e 12 – O osso particulado preenchendo perfeitamente a cavidade e, sendo recoberta toda a região com a barreira biológica.
A manobra cirúrgica conclui-se com a sutura, tomando-se o cuidado de ocluir perfeitamente toda a loja cirúrgica e os implantes (Fig. 13).
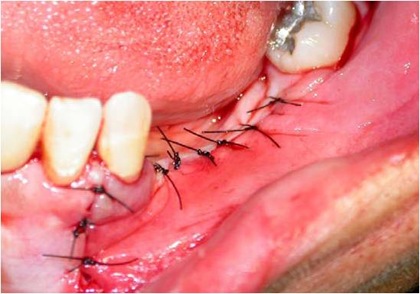
Fig. 13 – A sutura realizada ocluindo-se perfeitamente toda a cirurgia.
No pós-operatório são prescritas as orientações com o ferimento cirúrgico, antibioticoterapia, antiinflamatórios e analgésicos. São avaliadas periodicamente as alterações sensoriais e sua evolução, além dos controles radiográficos dos implantes (Fig. 14).
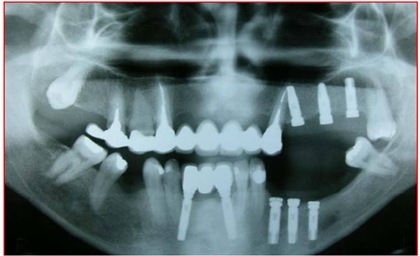
Fig. 14 - Controle radiográfico ortopantomográfico dos implantes e da alteração na anatomia mandibular.
A transposição do NAI geralmente causa alguns degraus de alterações sensoriais, sendo os mais comuns a hipoestesia (perda parcial da sensibilidade), a parestesia (resposta anormal a estímulos) (33).
A lesão nervosa ocorre devido à isquemia provocada pela distensão do nervo durante o procedimento cirúrgico (11) ou pela compressão/distensão crônica do mesmo após a cirurgia (21).
A avaliação clínica dessas alterações consiste:
1. no questionamento do paciente quanto à perda sensorial, a severidade dos distúrbios sensoriais, o grau de recuperação pós-operatória e, sua opinião sobre o custo-benefício desse procedimento (21).
2. em avaliações da sensibilidade nervosa, constituída de testes de sensibilidade térmica e, principalmente, da sensibilidade tátil através do toque, da discriminação do sentido do toque e, da discriminação dos dois pontos (20). Pode ainda utilizar-se de testes eletrofisiológicos para avaliar se há condução nervosa e, a velocidade da mesma (21, 33).
O tempo de carga dos implantes normalmente é postergado para 6 a 8 meses após a fixação dos implantes (10), devido à remoção de estrutura óssea na região entre as corticais superior e basal (Figs. 15, 16 e 17).
Os implantes fixados juntamente com a transposição do NAI apresentam taxa de sucesso semelhante aos implantes fixados sem auxílio de outras técnicas e, excetuando as alterações sensoriais, as complicações relatadas na literatura também são comuns àquelas presentes nas fixações de implantes sem uso de técnicas avançadas.
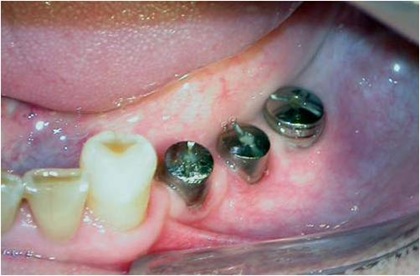
Fig. 15 – Aspecto clínico oito meses após a colocação dos implantes e da transposição do plexo nervoso.
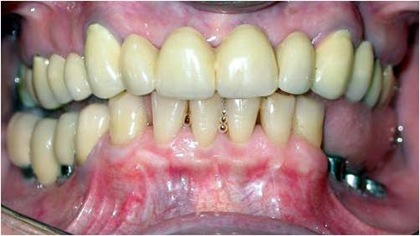
Fig. 16 – Aspecto clínico do caso antes da colocação da prótese.
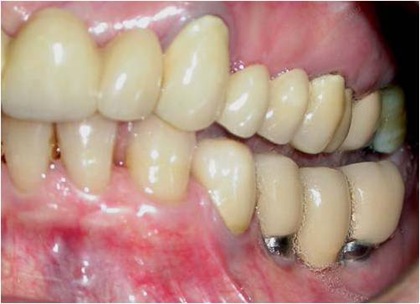
Fig. 17 – Aspecto clínico do caso após a colocação da prótese.
CONCLUSÕES
A transposição do nervo alveolar inferior não é um procedimento de última escolha. Trata-se de uma técnica cirúrgica com indicações específicas, e que obtêm ótimos resultados. Como o cirurgião Bucomaxilofacial geralmente já está familiarizado com os princípios cirúrgicos envolvidos, do ponto de vista puramente cirúrgico essa cirurgia não é o último recurso e, além disso, as outras opções de tratamento, também, envolvem diversos riscos. Para que a indicação desta técnica seja adequada primeiramente o paciente deve ter pleno esclarecimento das outras possibilidades de reabilitação e das possíveis seqüelas, além de concordar com o tratamento proposto.
Em relação às diversas variações propostas para esse procedimento é ponto pacífico, quanto às osteotomias, que devem permitir suficiente visualização do NAI, porém terem o menor tamanho necessário para não fragilizar a mandíbula e, facilitar o reparo ósseo, tomando-se especial atenção para preservar o máximo de osso acima do canal, para não interferir na estabilidade do implante e fragilizar a mandíbula. Essas osteotomias devem ser feitas em bloco, porque o desgaste progressivo com brocas além de tornar a manipulação do nervo mais difícil, facilita a lesão do mesmo.
A escolha da lateralização ou da transposição, além da indicação formal, depende mais da familiaridade do cirurgião com a técnica, uma vez que tanto são obtidos resultados satisfatórios e insatisfatórios com essas duas variações, ou seja, os resultados satisfatórios estão diretamente relacionados à habilidade da equipe cirúrgica em manipular o NAI com o mínimo de tracionamento.
REFERÊNCIAS
01. ALLING, C. A. Lateral reposition of inferior alveolar neurovascular bundle. J. oral Surg.v.35, p.419, may, 1977.
02. BABBUSH, C. A. Transposition and repositioning the inferior alveolar and mental nerves in conjunction with endosteal implant reconstruction. Periodontol. 2000, v.17, p.183-90, jun., 1998.
03. BAVITZ, J. B. et al., An Anatomical study of mental neurovascular bundle implants relationships. Int. J. oral Maxillofac. Impl. v.8, n.5, p.563-7, 1993.
04. CHOSSEGROS, C. et al., Lateralisation totale du nerf alveolaire inferieur, etude preliminare, a propos d’un cas. Rev. Stomatol. Chir. Maxillofac. v. 93, n. 3, 171-4, 1995.
05. CHOUKAS, N. C.; TOTO, P. D.; NOLAN, R. F. Histological study of regeneration of inferior alveolar nerve. J. oral Surg. v. 32, p. 347-52, may, 1974.
06. DARIO, L. J.; ENGLISH Jr, R. Achieving implant reconstruction through bilateral mandibular nerve repositioning. J. Amer. dent. Ass. v. 125, n. 3, p. 305-9, mar., 1994.
07. ELLIES, L. G. et al., Inferior alveolar nerve repositioning: is there cause for concern ? Dent. Implant. Update v. 6, n. 4, p. 30-2, abr., 1995.
08. __________________ Inferior alveolar nerve repositioning: is there cause for concern? Dent. Implant. Update v.6, n.5, p.37-9, may, 1995.
09. FRIBERG, B.; IVANOFF, C. J.; LEKHOLM, U. Inferior alveolar nerve transposition in combination with Branemark implant treatment. Int. J. Periodont. Res. Dent. v. 12, n. 6, p. 440-9, 1992.
10. GARG, A. K.; MORALES, M. J. Lateralization of the inferior alveolar nerve with simultaneous implant placement, surgical techniques. Pract. Periodont. Aesthetic Dent. v. 10, n. 9, p. 1197-206, nov.,/dec., 1998.
11. HIRSCH, J. M.; BRANEMARK, P. I. Fixure stability and nerve function after transposition and lateralization of the inferior alveolar nerve and fixure installation. Brit. J. oral Maxillofac. Surg. v. 33, n. 5, p. 276-81, oct., 1995.
12. JENSEN, J.; REICHE-FISCHEL, O.; SINDET-PEDERSEN, S. Nerve transposition and implant placement in the atrophic posterior mandibular alveolar ridge. J. oral. Maxillofac. Surg. v. 52, n. 7, p. 662-70, jul., 1994.
13. JENSEN, O.; NOCK, D. Inferior alveolar nerve repositioning in conjunction with placement of osseointegrated implants: a case report. Oral Surg. v. 63, n. 3, p. 263-70, mar., 1987.
14. KAHNBERG, K. E.; RIDELL, A. Transposition of the mental nerve in orthognathic surgery. J. oral Maxillofac. Surg. v. 45, n. 4, p. 315-8, apr., 1987.
15. KAN, J. Y. et al., Mandibular fracture after endosseous implant placement in conjunction with inferior nerve transposition: a patient treatment report. Int. J. oral Maxillofac. Impl. v. 12, n. 5, p. 655-9, sep.,/oct., 1997.
16. KINGLE, B.; PETERSSON, A.; MALY, P. Location of the mandibular canal: comparison of macroscopic findings, conventional radiography, and computed tomography. Int. J. oral. Maxillofac. Impl. v. 4, n. 4, p. 327-32, 1989.
17. KOOMEN, H. A. et al. Interposed bone-graft augmentation of the atrophic mandible. J. Maxillofac. Surg. v. 7, p. 129-35, 1979.
18. KROGH, P.H., et al., Does the risk of complication make transpositioning the inferior alveolar nerve in conjunction with implant placement a “last resort” surgical procedure? Int. J. oral. Maxillofac. Impl. v. 9, n. 2, p. 249-54, mar.,/apr., 1994.
19. MAC INTOSH, R. B. Total mandibular segmental alveolar osteotomy. J. Maxillofac. Surg. v. 2, n. 4, p. 210-8, 1974.
20. NISHIOKA, G.; ZYSSET, M.; VON SICKEELS, L. Neurosensory disturbance with rigid fixation of the bilateral sagittal splint osteotomy. J. oral Maxillofac. Surg. v. 45, n. 1, p. 20-26, 1987.
21. NOCINI, et al., Clinical and electrophysiological assessment of inferior alveolar nerve function after lateral nerve transposition. Clin. oral Impl. Res. v. 10, n. 2, p. 120-30, apr., 1999.
22. ONSTAD, M. S. Repositioning of inferior alveolar nerve for dental implants. Dent. Implant. Update v. 9, n. 7, p. 53-6, jul., 1998.
23. PETERSEN, L. Posterior mandibular segmental alveolar osteotomy. J. oral Surg. v. 36, n. 6, p. 454-8, 1978.
24. ROSENQUIST, B. Implant placement in combination with nerve transpositioning: experiences with the first 100 cases. Int. J. oral. Maxillofac. Impl. v. 9, n. 5, p. 522-31, 1994.
25. _____________________Fixure placement posterior to the mental foramen with transpositioning of the inferior alveolar nerve. Int. J. oral. Maxillofac. Impl. v. 7, n. 1, p. 45-50, 1992.
26. RUGGE, G.; LEKHOLM, U.; NEVINS, M. Osseointegration and nerve transposition after mandibular resection to treat ameloblastoma: a case report. Int. J. Periodont. Res. Dent. v. 15, n. 4, p. 396-403, aug., 1995.
27. SETHI, A. Inferior alveolar nerve repositioning in inplant dentistry: a preliminary report. Int. J. Periodont. Res. Dent. v. 15, n. 5, p. 474-81, oct., 1995.
28. ____________Inferior alveolar nerve repositioning in inplant dentistry: clinical report. Implant Dent. v. 2, n. 3, p. 195-7, fev., 1993.
29. SHIBAHARA, T. et al., Transposition of the mental nerve and inferior alveolar nerve trunk. Bull. Tokyo dent. Coll. v. 37, n. 2, p. 103-7, may, 1996.
30. SMILER, D. G. Repositioning the inferior alveolar nerve for placement of endosseous implants: technical note. Int. J. oral. Maxillofac. Implantol. v. 8, n. 2, p. 145-50, 1993.
31. TOLEDO-FILHO, J. L.; MARZOLA, C.; TOLEDO NETO, J. L. Estudo morfométrico seccional da mandíbula aplicado às técnicas de implantodontia, cirurgia e traumatologia bucomaxilofacial. Rev. Fac. Odontol. Bauru, v. 6, n. 1, p. 23-39, jan.,/mar., 1998.
32. URBANI, G. et al., Distraction osteogenesis to achieve mandibular vertical bone renegeration: case report. Int. J. Periodont. Res. Dent. v. 19, n. 4, p. 312-31, 1999.
33. WALTER Jr., J. M.; GREGG, J. M. Analysis of post-surgical neurological alteration in the trigeminal nerve. J. oral Surg. v. 37, p. 410-4, jun., 1979.
34. WOLFSOHN, B. El daño neural, en la práctica implantológica. Disponível site: Dental World URL: http://www.gbsystems.com/papers/implante/implan1.htm Consultado em 26 de julho de 2000.
35. WORTHINGTON, P.; RUBENSTEIN, J. E. Problems associated with the atrophic mandible. Dent. Clinics North Amer. v. 42, n. 1, p. 129-60, jan., 1998.